पाठ्यपुस्तकों में तो हमने यही पढ़ा है कि किसी व्यक्ति की सारी कोशिकाएं जेनेटिक रूप से हू-ब-हू एक जैसी होती है। यह ज़रूर संभव है कि कोशिकाओं में डीएनए की अभिव्यक्ति अलग-अलग हो लेकिन सूचना का भंडार एक ही रहता है। यह भी बताया जाता है कि उम्र के साथ डीएनए के आसपास एपिजेनेटिक परिवर्तन (epigenetic changes) होते रहते हैं, जिनकी वजह से उसके कामकाज पर असर होता है। लेकिन हाल में एक 74 वर्षीय व्यक्ति की 100 अलग-अलग कोशिकाओं के पूरे जीनोम के विश्लेषण (genome analysis) ने हैरतअंगेज़ परिणाम प्रदान किए हैं।
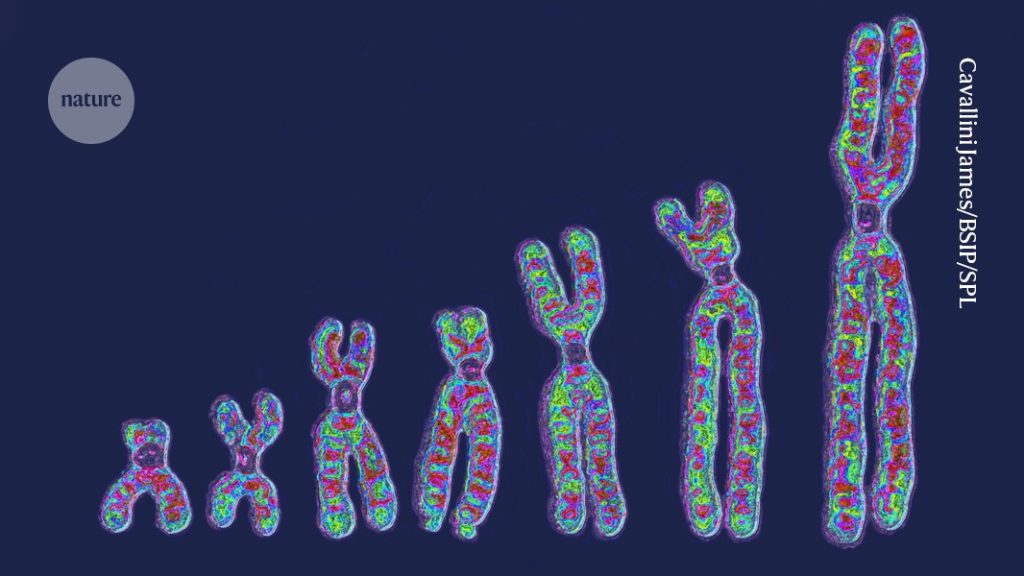
इन 100 कोशिकाओं में से किसी में गुणसूत्र में एक अतिरिक्त भुजा थी, किसी में डीएनए के छोटे-छोटे टुकड़े एक-दूसरे से भिन्न थे, विलोपित हो गए थे या दोहरे हो गए थे। कुछ कोशिकाओं में तो Y गुणसूत्र पूरी तरह नदारद (Y chromosome loss) था। बायोआर्काइव्स-1 में प्रकाशित शोध पत्र के एक लेखक हारवर्ड मेडिकल स्कूल के जो लुक्वेट कहते हैं कि कुछ कोशिकाएं तो एकदम गड्ड-मड्ड थीं।
दरअसल, एक ही व्यक्ति की कोशिकाओं में जेनेटिक विविधता (genetic variation) का अध्ययन एक अहम सरोकार रहा है। कारण यह है कि एक ही व्यक्ति की कोशिकाओं के बीच जेनेटिक भिन्नता (मोसेइसिज़्म या पच्चीकारिता) का असर स्वास्थ्य और कैंसर जैसी कई बीमारियों पर होता है।
जब व्यक्ति के शरीर की सारी कोशिकाएं एक ही मूल कोशिका (जॉ़यगोट) से बनी हैं, तो यह विविधता कहां से आती है। इन विविधताओं के कई स्रोत हो सकते हैं – जैसे डीएनए के प्रतिलिपिकरण या मरम्मत के दौरान होने वाली त्रुटियां, या डीएनए को क्षति पहुंचाने वाले पर्यावरणीय कारकों (पराबैंगनी प्रकाश या धूम्रपान – UV radiation, smoking) का असर।
वैसे तो इन बातों का अंदाज़ा पहले से था, लेकिन पिछले कुछ वर्षों में डीएनए के अनुक्रमण (DNA sequencing technology) की टेक्नॉलॉजी में बहुत तरक्की हुई है। इससे यह समझने में मदद मिली है कि मोसेइसिज़्म कितना सामान्य है और यह स्वास्थ्य को कैसे प्रभावित करता है। उदाहरण के लिए, कुछ कोशिकाओं में लंबे समय में संग्रहित उत्परिवर्तन कैंसर का कारण बन सकते हैं। रक्त कोशिकाओं में Y गुणसूत्र का अभाव (Y chromosome deletion) कार्डियोवैस्कुलर रोगों और हार्ट अटैक (heart disease risk) से जुड़ा पाया गया है।
अब तक इन अंतरों का मानचित्र तैयार करके यह देख पाना मुश्किल था कि ये जीवन के किस पड़ाव में पैदा होते हैं। कारण यह है कि अधिकांश जीनोम अध्ययनों में कई सारी कोशिकाओं का डीएनए एक साथ निकालकर थोक में अनुक्रमण किया जाता है। तब एक प्रारूपिक जीनोम सामने आता है और एक-एक कोशिका में डीएनए की स्थिति नहीं दिखती। इसके अलावा, एक-एक कोशिका के जीनोम विश्लेषण के तरीके (single-cell genome analysis) परिष्कृत हुए हैं लेकिन आम तौर पर इन आधुनिक तकनीकों का उपयोग डीएनए नहीं बल्कि आरएनए के अध्ययन हेतु किया गया है। बोस्टन चिल्ड्रेन्स हॉस्पिटल की डिआने शाओ के मुताबिक इसका कारण यह है कि किसी भी कोशिका में आरएनए की तो कई प्रतियां एक साथ मौजूद होती हैं लेकिन डीएनए की दो ही प्रतियां पाई जाती हैं। वर्तमान अध्ययन ने इस चुनौती को स्वीकार करके आगे की राह दिखाई है। (स्रोत फीचर्स)
नोट: स्रोत में छपे लेखों के विचार लेखकों के हैं। एकलव्य का इनसे सहमत होना आवश्यक नहीं है।
Photo Credit : https://media.nature.com/lw1200/magazine-assets/d41586-025-03768-0/d41586-025-03768-0_51720290.jpg