दशकों से दर्द से राहत के लिए अफीमी दवाओं (ओपिओइड) का उपयोग किया जा रहा है। लेकिन ये दवाएं अक्सर जीर्ण दर्द पर अप्रभावी रहती हैं और इनकी लत लग सकती है। इसलिए वैज्ञानिक दर्द से राहत पाने के अन्य विकल्प तलाशने में लगे हैं।
अब, नॉर्थवेस्टर्न युनिवर्सिटी के जॉन रॉजर्स के नेतृत्व में शोधकर्ताओं ने चूहों में एक ऐसा छोटा इम्प्लांट फिट किया है जो मस्तिष्क और शरीर के अन्य हिस्सों में सूचना प्रसारित करने वाली परिधीय तंत्रिकाओं को शीतल करता है।
यह मुलायम इम्प्लांट पानी में घुलनशील और जैव-संगत सामग्री से बना है जो इसे परिधीय तंत्रिका के चारों ओर लिपटने लायक बनाता है। इसकी अनूठी संरचना की बदौलत यह बहुत ही छोटे-से हिस्से (कुछ मिलीमीटर) की तंत्रिकाओं को भी सटीकता से लक्षित और शीतल कर सकता है। वैसे तो तंत्रिकाओं को शीतल करने की अन्य तकनीकें भी मौजूद हैं लेकिन वे उतनी सटीक नहीं हैं और लक्ष्य के आसपास के मांसपेशीय ऊतकों को नुकसान पहुंचा सकती हैं। तंत्रिका दर्द को रोकने के लिए दिए जाने वाले फिनॉल इंजेक्शन में फिनॉल के अवांछित जगहों पर भी फैलने की संभावना रहती है।
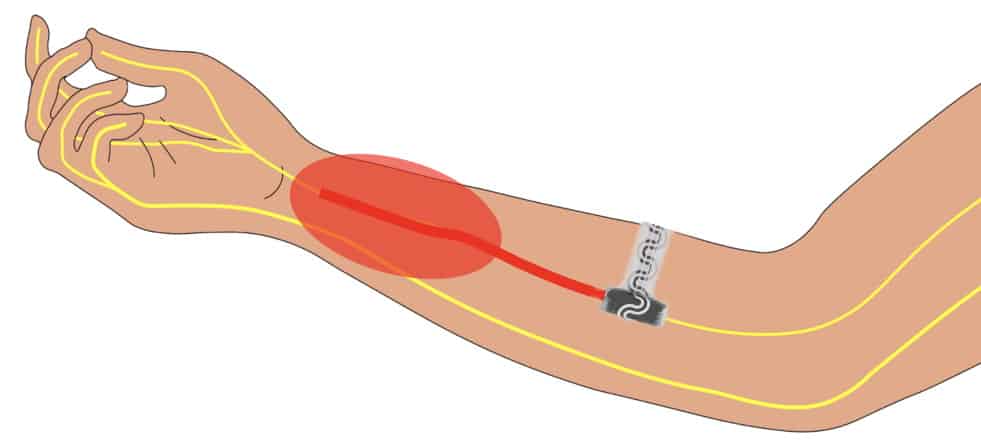
इस नए इम्प्लांट में छोटे-छोटे चैनल होते हैं जिसके माध्यम से परफ्लोरोपेंटेन नामक शीतलन एजेंट को शरीर में पहुंचाया जा सकता है। एक अन्य चैनल में शुष्क नाइट्रोजन होती है। जब एक चेम्बर में परफ्लोरोपेंटेन शुष्क नाइट्रोजन से मिलता है, तो यह तुरंत वाष्पित हो जाता है और तंत्रिकाओं को 10 डिग्री सेल्सियस तक ठंडा कर देता है। विचार यह है कि जैसे-जैसे तंत्रिकाएं शीतल होंगी, वैसे-वैसे उनके माध्यम से प्रसारित होने वाले विद्युत संकेतों की तीव्रता और आवृत्ति भी मंद होगी। और आखिरकार, तंत्रिकाएं दर्द के संकेत तथा अन्य सूचनाएं प्रसारित करना बंद कर देंगी। प्रत्यारोपण के 20 दिन बाद यह प्रत्यारोपण घुल जाता है, और उसके 30 दिन के अंदर किडनियां इसे उत्सर्जित कर देती हैं।
इस डिवाइस का परीक्षण करने के लिए शोधकर्ताओं ने चूहों के पंजों में एक महीन तार (तंतु) चुभाया और इससे उपजे दर्द के प्रति उनमें प्रतिक्रिया प्रेरित करने के लिए ज़रूरी बल को नापा। फिर उन्होंने चूहों की साएटिक नसों (जो कमर से पैरों तक जाती है) को ठंडा करने के लिए उनमें यह डिवाइस लगाई और वापस तार चुभाकर देखा।
साइंस में प्रकाशित नतीजों के अनुसार जब दर्द-संकेतों को अवरुद्ध किया गया तो प्रतिक्रिया उत्पन्न करने के लिए ज़रूरी बल काफी बढ़ गया था। यह दर्शाता है कि यह उपकरण परिधीय तंत्रिका तंत्र द्वारा संचारित संकेतों को अवरुद्ध करने में सक्षम है और दर्द के अहसास कम कर देता है। शोधकर्ताओं का अनुमान है कि यह प्रत्यारोपण मनुष्यों में भी इसी तरह से कारगर हो सकता है, और सर्जरी के बाद उपजे दर्द से राहत के लिए लगाया जा सकता है। हालांकि, डिवाइस अभी मनुष्यों में परीक्षण के लिए तैयार नहीं है।
कुछ वैज्ञानिकों का मत है कि यह डिवाइस अनुपस्थित (फैंटम) अंग में होने वाले दर्द को खत्म नहीं कर सकता है, क्योंकि इस मामले में दर्द अंग कट जाने के बाद मस्तिष्क में हुए पुनर्गठन से जुड़ा होता है।
अन्य वैज्ञानिकों का मत है यह तो सही है कि दर्द संवेदना में परिधीय तंत्रिका तंत्र की भूमिका होती है, लेकिन यही अकेला कारक नहीं है और शायद सबसे प्रमुख भी न हो। रॉजर्स इस बात से सहमत हैं कि तंत्रिकाओं के अलावा दर्द को नियंत्रित करने वाले कई अन्य कारक भी हैं। जैसे मनोवैज्ञानिक प्रभाव, लेकिन वे इतने महत्वपूर्ण शायद नहीं है।
टीम की योजना अब तंत्रिका शीतलन प्रणाली की बारीकियों पर काम करने की है; मसलन तंत्रिका को शीतल रखने की वह संतुलित अवधि पता करना जितनी देर में वह दर्द संकेत अवरुद्ध कर दे लेकिन ऊतकों को नुकसान न पहुंचाए। यह भी देखना होगा कि शीतलन प्रक्रिया को पलटने में कितना समय लगेगा। उपकरण को और छोटा बनाने की कोशिश भी की जाएगी। (स्रोत फीचर्स)
नोट: स्रोत में छपे लेखों के विचार लेखकों के हैं। एकलव्य का इनसे सहमत होना आवश्यक नहीं है।
Photo Credit : https://www.syfy.com/sites/syfy/files/styles/scale–1200/public/2022/07/nerve_cooling_device.jpg
https://physicsworld.com/wp-content/uploads/2022/07/nerve-cooling-schematic.jpg