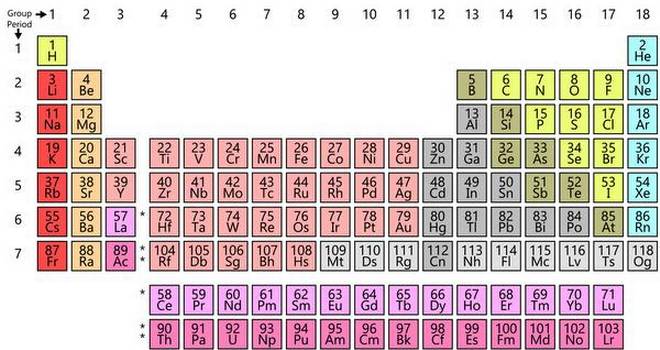
दुनिया लोग सदियों से सोना, चांदी, पारा, लोहा, फॉस्फोरस जैसे कई पदार्थों के बारे में जानते थे और उनका उपयोग करते थे। कीमियागरों ने भी ‘सस्ती’ धातुओं से सोना बनाने की कई कोशिशें कीं मगर नाकाम रहे। लेकिन साल 1808 में अंग्रेज़ अध्यापक जॉन डाल्टन ने ‘रासायनिक दर्शन की नई प्रणाली’ प्रस्तुत की जिसमें उन्होंने बताया कि सभी रासायनिक तत्व परमाणुओं से बने होते हैं; कोई भी तत्व एक ही प्रकार के परमाणुओं से मिलकर बना होता है और हर परमाणु का अपना एक निश्चित भार होता है; और दो अलग-अलग तत्वों के परमाणुओं के परस्पर संयोग के फलस्वरूप ही रासायनिक क्रियाएं होती हैं। इंग्लैंड के डाल्टन और थॉमस थॉमसन ने हाइड्रोजन परमाणु के भार को 1 निर्धारित किया (या इकाई माना) जबकि युरोप के बर्जीलियस ने ऑक्सीजन का परमाणु भार 100 माना। आगे इन्हीं इकाइयों के आधार पर अन्य तत्वों के परमाणु भार पता किए गए। 1860 के दशक तक कई ज्ञात तत्वों के परमाणु भार पता किए जा चुके थे।
उस वक्त रासायनज्ञों के मन में एक सवाल घूम रहा था कि क्या किसी वर्ग के तत्वों (जैसे लीथियम, सोडियम और पोटेशियम) के गुणधर्मों में समानता और उनके परमाणु भारों को देखकर कोई पैटर्न (या तर्क) निकाला जा सकता है? 1817 में जर्मनी के जॉहेन डॉबराइनर ने पाया कि यदि समान गुणधर्म वाले तत्वों की तिकड़ी को लें तो बीच वाले तत्व का परमाणु भार अन्य दो तत्वों के परमाणु भार के औसत के करीब होता है। उदाहरण के तौर पर सोडियम का परमाणु भार (23) लीथियम (परमाणु भार 7) और पोटेशियम (परमाणु भार 39) के औसत के करीब है। इसी तरह ब्राोमीन का परमाणु भार (80), क्लोरीन (35) और आयोडीन (127) के मध्य है। और फिर 1865 में रसायनज्ञ जॉन न्यूलैंड्स ने ‘अष्टक का नियम’ प्रतिपादित किया था, जिसके अनुसार यदि तत्वों को उनके परमाणु भार के अनुसार बढ़ते क्रम में जमाया जाए तो हर आठवें तत्व के गुणधर्म पहले तत्व के समान होंगे (जैसे लीथियम और सोडियम, या कार्बन और सिलिकॉन)।
इसी संदर्भ में साल 1865 में ही रूस के सेंट पीट्सबर्ग विश्वविद्यालय के प्रोफेसर दीमित्री मेंडलीव भी काम कर रहे थे। वे उस वक्त की मौजूदा पाठ्यपुस्तकों से संतुष्ट नहीं थे, इसलिए स्वयं एक पाठ्यपुस्तक लिख रहे थे। लेकिन किताब लिखने के लिए उन्हें तत्वों को व्यवस्थित और तार्किक क्रम में जमाना था। साइंस न्यूज़ के 9 जनवरी 2019 के अंक में डॉ. टॉम सीगफ्राइड लिखते हैं कि मेंडलीव ने उस वक्त तक ज्ञात सभी 69 तत्वों और उनके गुणधर्मों को अलग-अलग कार्ड पर लिखा। फिर इन कार्डस को एक खड़ी रेखा में बढ़ते परमाणु भार के क्रम में जमाया। उन्होंने पाया कि परमाणु भार के आधार पर एक क्रम में जमाने पर एक निश्चित अंतराल पर तत्वों में गुणों का दोहराव दिखाई देता है और “किसी तत्व के परमाणु भार से उस तत्व के गुणधर्म निर्धारित होते हैं।” उन्होंने अपनी इस खोज को 1 मार्च 1869 को रशियन केमिकल सोसायटी में प्रस्तुत किया था। और इस तरह आवर्त सारणी अस्तित्व में आई। (इस संदर्भ में, सीगफ्राइड का उपरोक्त उम्दा, स्पष्ट और पठनीय लेख ‘How the periodic table went from a sketch to an enduring masterpiece’ इंटरनेट पर मुफ्त में उपलब्ध है।
भविष्यवाणी की ताकत
मेंडलीव की आवर्त सारणी ने ना केवल डॉबराइनर और न्यूलैंड्स के इस विचार की पुष्टि की कि हर आठवां तत्व गुणधर्मों को दोहराता है, बल्कि इससे आगे गई। इस आवर्त सारणी के आधार पर उन्होंने भविष्यवाणी की थी कि सिलिकॉन जैसे गुणधर्मों वाले एक तत्व की खोज होगी जिसका परमाणु भार 72 होगा (इसे उन्होंने एका-सिलिकॉन नाम दिया था)। आगे जाकर साल 1886 में यह तत्व खोजा गया और इसे जर्मेनियम नाम दिया गया। इसी तरह उन्होंने एका-एल्यूमिनियम नामक तत्व के बारे में पूर्वानुमान लगाया था, जिसे साल 1875 में खोजा गया और इसे नाम दिया गया गैलियम। गैलियम में वे सारे गुणधर्म थे जिनके होने की भविष्यवाणी मेंडलीव ने की थी।
सीगफ्राइड लिखते हैं कि “मेंडेलीव की आवर्त सारणी ने रसायन शास्त्र को मध्ययुगीन जादुई रहस्यवादी किमियागरी से आधुनिक रसायन विज्ञान की गहनता प्रदान की। आवर्त सारणी ना सिर्फ पदार्थ के घटकों का प्रस्तुतीकरण है बल्कि यह समस्त विज्ञान की अकाट्य तार्किकता और तर्कसंगतता का भी प्रतिनिधित्व करती है।”
डॉल्टन और मेंडेलीव के अनुसार परमाणु किसी तत्व की वह सूक्ष्मतम इकाई है जिसे और विभाजित नहीं किया जा सकता। लेकिन 1900 के दशक में आधुनिक भौतिकी ने दर्शाया कि परमाणु में एक केंद्रीय नाभिक (जिसमें प्रोटॉन और न्यूट्रॉन होते हैं) होता है और इलेक्ट्रॉन नाभिक के चारों और विभिन्न कक्षाओं में चक्कर लगाते रहते हैं, कुछ हद तक वैसे ही जैसे ग्रह सूर्य के चारों और चक्कर लगाते हैं। किसी परमाणु में प्रोटॉन की संख्या को परमाणु संख्या कहते हैं। इस विचार ने रसायनज्ञों को तत्वों को परमाणु संख्या के आधार पर व्यवस्थित करने की प्रेरणा दी। परमाणुओं की बाहरी कक्षा में स्थित इलेक्ट्रॉन तत्व के रासायनिक गुण निर्धारित करते हैं।
परमाणु की कक्षाएं बढ़ते स्तर में व्यवस्थित की गई हैं। यह आवर्तता मेंडेलीव की आवर्त सारणी की व्यवस्था और उनके पूर्वानुमान से मेल खाती है। देखा जाए तो मेंडेलीव भविष्यदृष्टा थे। और आवर्त सारणी तत्वों को एक व्यवस्थित क्रम में जमाने का शानदार विचार था, जिसकी इस वर्ष (2019 में) हम 150वीं वर्षगांठ मना रहे हैं।
इस अवसर पर, चेन्नई के इलेक्ट्रोकेमिकल रिसर्च इंस्टीट्यूटके डॉ. अशोक के. आर. पॉल ने आवर्त सारणी को एक काव्यात्मक श्रद्धांजलि दी है। आवर्त सारणी पर लिखी गई कविता का आनंद आप नीचे दी गई लिंक पर पढ़कर ले सकते हैं – https://euroscientist.com/ode-to-the-periodic-table/ (स्रोत फीचर्स)
नोट: स्रोत में छपे लेखों के विचार लेखकों के हैं। एकलव्य का इनसे सहमत होना आवश्यक नहीं है।
Photo Credit : https://th.thgim.com/sci-tech/6v1853/article26224711.ece/alternates/FREE_660/22